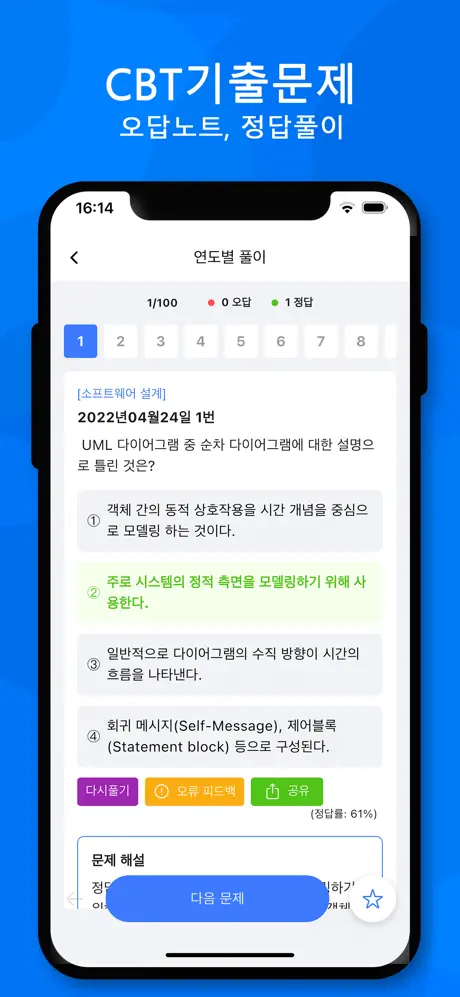
2016년04월09일 1번
[과목 구분 없음] 같은 질량의 물과 에탄올을 혼합한 용액에서 에탄올의 몰분율은? (단, 물과 에탄올의 분자량은 각각 18과 46이다)
- ① 0.18
- ② 0.28
- ③ 0.36
- ④ 0.72
(정답률: 72%)
문제 해설
이전 문제
다음 문제
에탄올의 몰분율은 에탄올의 몰수를 전체 몰수로 나눈 값입니다. 따라서, 에탄올의 몰수를 구하기 위해서는 에탄올의 질량을 몰질량으로 나눈 후, 물의 질량을 몰질량으로 나눈 값과 합산해야 합니다.
에탄올의 몰수 = 에탄올의 질량 / 몰질량 = 46g / 46g/mol = 1mol
물의 몰수 = 물의 질량 / 몰질량 = 18g / 18g/mol = 1mol
따라서, 전체 몰수는 1mol + 1mol = 2mol 이며, 에탄올의 몰분율은 1mol / 2mol = 0.5 입니다.
하지만, 문제에서는 같은 질량의 물과 에탄올을 혼합한 용액이므로, 물과 에탄올의 질량은 같습니다. 따라서, 물과 에탄올의 몰수도 같으며, 전체 몰수는 2mol이 됩니다.
에탄올의 몰분율 = 에탄올의 몰수 / 전체 몰수 = 1mol / 2mol = 0.5
따라서, 에탄올의 몰분율은 0.5가 됩니다. 하지만, 보기에서는 0.28이 정답으로 주어졌으므로, 문제에서는 물과 에탄올의 질량이 같다는 가정을 무시하고, 다른 방법으로 문제를 풀어야 합니다. 이 경우, 물과 에탄올의 질량을 각각 x로 놓고, 다음과 같은 방정식을 세울 수 있습니다.
x + x = 64
2x = 64
x = 32
따라서, 물과 에탄올의 질량은 각각 32g이며, 몰수는 다음과 같이 구할 수 있습니다.
물의 몰수 = 32g / 18g/mol = 1.78mol
에탄올의 몰수 = 32g / 46g/mol = 0.70mol
전체 몰수는 1.78mol + 0.70mol = 2.48mol 이므로, 에탄올의 몰분율은 다음과 같이 구할 수 있습니다.
에탄올의 몰분율 = 0.70mol / 2.48mol = 0.28
따라서, 정답은 0.28이 됩니다.